Monitoring du flux sanguin cérébral
![]()
Le système PSI pour le monitoring du flux sanguin cérébral
La combinaison unique d’une haute résolution spatiale, d’un grand champ de vision et d’une haute fréquence d’images fait du PeriCam PSI l’instrument idéal pour obtenir des images de grande qualité du cerveau et surveiller les changements rapides.
Les changements du flux sanguin cérébral (FSC) sont caractéristiques de bon nombre de troubles neurologiques et sont dès lors au cœur de nombreuses études dans le domaine des neurosciences. Ces études impliquent l’utilisation d’outils pour examiner ces changements, de préférence selon des méthodes non invasives en temps réel. Le système PeriCam PSI est un imageur de perfusion sanguine utilisant la technologie de l’analyse du contraste speckle laser (LASCA). La technologie LASCA offre des moyens innovants pour l’étude de la microcirculation. Elle permet de visualiser la perfusion sanguine tissulaire en temps réel, et combine réponse dynamique et résolution spatiale. Elle n’influe pas sur la perfusion dans la mesure où elle ne nécessite aucun contact direct avec le tissu ni aucun produit de contraste ou élément traceur. Par ailleurs, afin d’étendre sa fonctionnalité, un logiciel d’application dédié, PIMSoft, a été développé. La PSI a largement été utilisée pour monitorer le FSC et ses modifications dans divers modèles murins afin de décrire une pathologie et de contrôler l’efficacité du traitement.
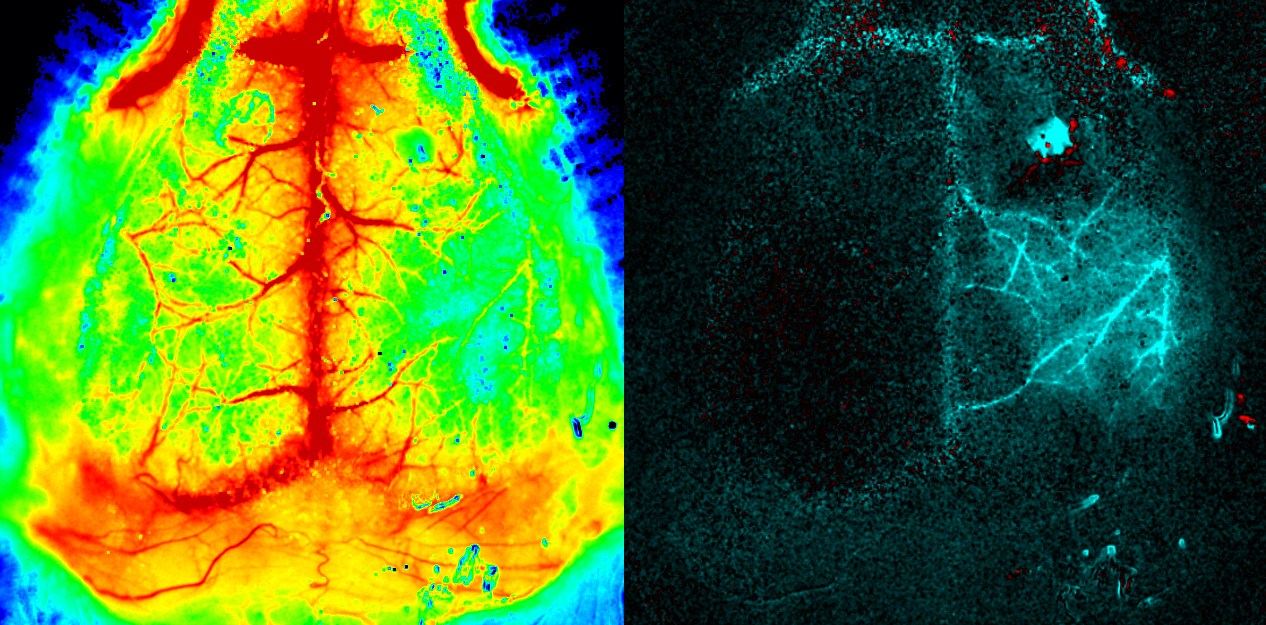
Cerveau de souris. PeriCam PSI HR (haute résolution) Images fournies par le Dr Offenhauser, Charité, Berlin, Allemagne.
Présentation
Le système PeriCam PSI a prouvé son utilité dans de nombreux domaines de la recherche sur le flux sanguin
cérébral, parmi lesquels l’analyse des lésions cérébrales ischémiques. Des AVC ischémiques et hémorragiques peuvent être induits, et le système PeriCam PSI permet de déterminer leur ampleur ainsi que de suivre l’évolution du processus dynamique après les AVC. De la même manière, le système PeriCam PSI peut être utilisé pour effectuer des analyses dans des modèles d’hypoperfusion cérébrale chronique et de lésions traumatiques du cerveau.
Un autre domaine est l’étude des changements hémodynamiques cérébraux, pour laquelle le système PeriCam PSI, grâce à sa combinaison unique de haute résolution spatiale, de grand champ de vision et de haute fréquence d’images, constitue un outil idéal pour analyser les modifications rapides du FSC. Cette technique est parfaitement adaptée à la visualisation des vagues de changement de perfusion qui surviennent dans le cas d’une dépression corticale envahissante, et le mode d’imagerie différentielle a été conçu dans cette optique. Plus récemment, cette technique a également prouvé son utilité dans le cadre du couplage neurovasculaire.
La PSI pour la caractérisation des lésions cérébrales ischémiques
Grâce à ses fonctionnalités uniques, la PSI convient à l’étude des lésions cérébrales ischémiques dans plusieurs modèles, notamment l’AVC, l’hypoperfusion cérébrale chronique et les lésions cérébrales traumatiques.
Vaste champ de vision : la visualisation de l’ensemble de la zone cérébrale permet de vérifier et de caractériser les lésions ischémiques
Résolution spatiale élevée : définit avec précision l’emplacement de la lésion. L’insertion de régions d’intérêt (ROI) permet de mesurer la zone atteinte et de suivre le rétablissement de la lésion.
Fonction de reprise de l’enregistrement : simplifie l’acquisition et l’analyse de données pour les études longitudinales en capturant des mesures répétées d’un même sujet dans un fichier unique, ce qui permet de comparer facilement des ROI identiques au fil du temps.
AVC
o Modèle d’occlusion de l’artère cérébrale moyenne (OACM) – Un filament est inséré dans l’artère afin d’obstruer le flux sanguin durant une période déterminée (généralement entre 30 et 120 minutes) avant de le retirer pour permettre une reperfusion entraînant un AVC ischémique 1-9.
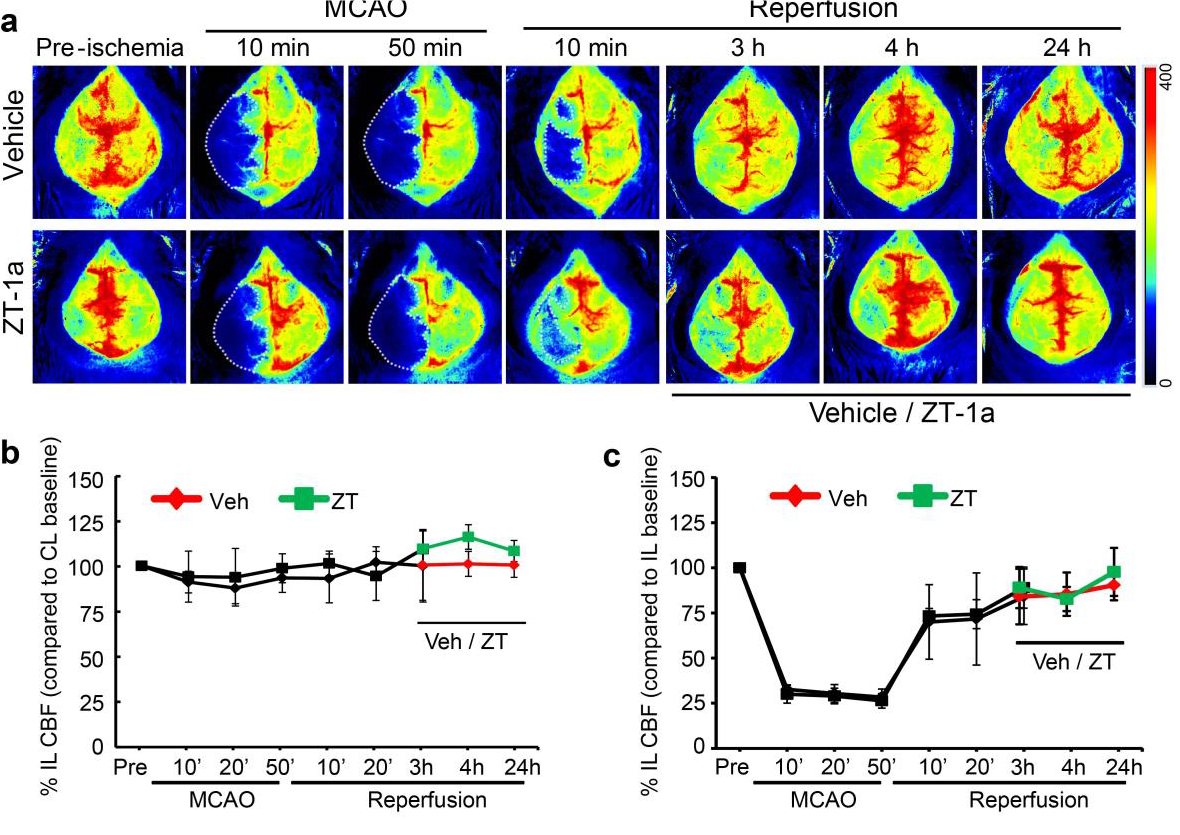
Images de la perfusion cérébrale d’un souris avant, pendant après OACM, avec quantification des changements de perfusion sanguine des côtés ipsilatéral et controlatéral chez l’animal traité et non traité.
Images fournies par Dandan Sun et Iqbal H. Bhuiyan, Département de neurologie et Pittsburgh Institute For Neurodegenerative Diseases, Université de Pittsburgh. Figure reproduite avec l’autorisation de Nature Communications, initialement publiée dans : Zhang, J., Bhuiyan, M.I.H., Zhang, T. et al. Modulation of brain cation-Cl− cotransport via the SPAK kinase inhibitor ZT-1a. Nat Commun 11, 78 (2020). DOI : 10.1038/s41467-019-13851-6
o Modèle d’hémorragie sous-arachnoïdienne (HSA) – Un filament est inséré pour perforer l’artère cérébrale antérieure, entraînant un AVC 10-13.
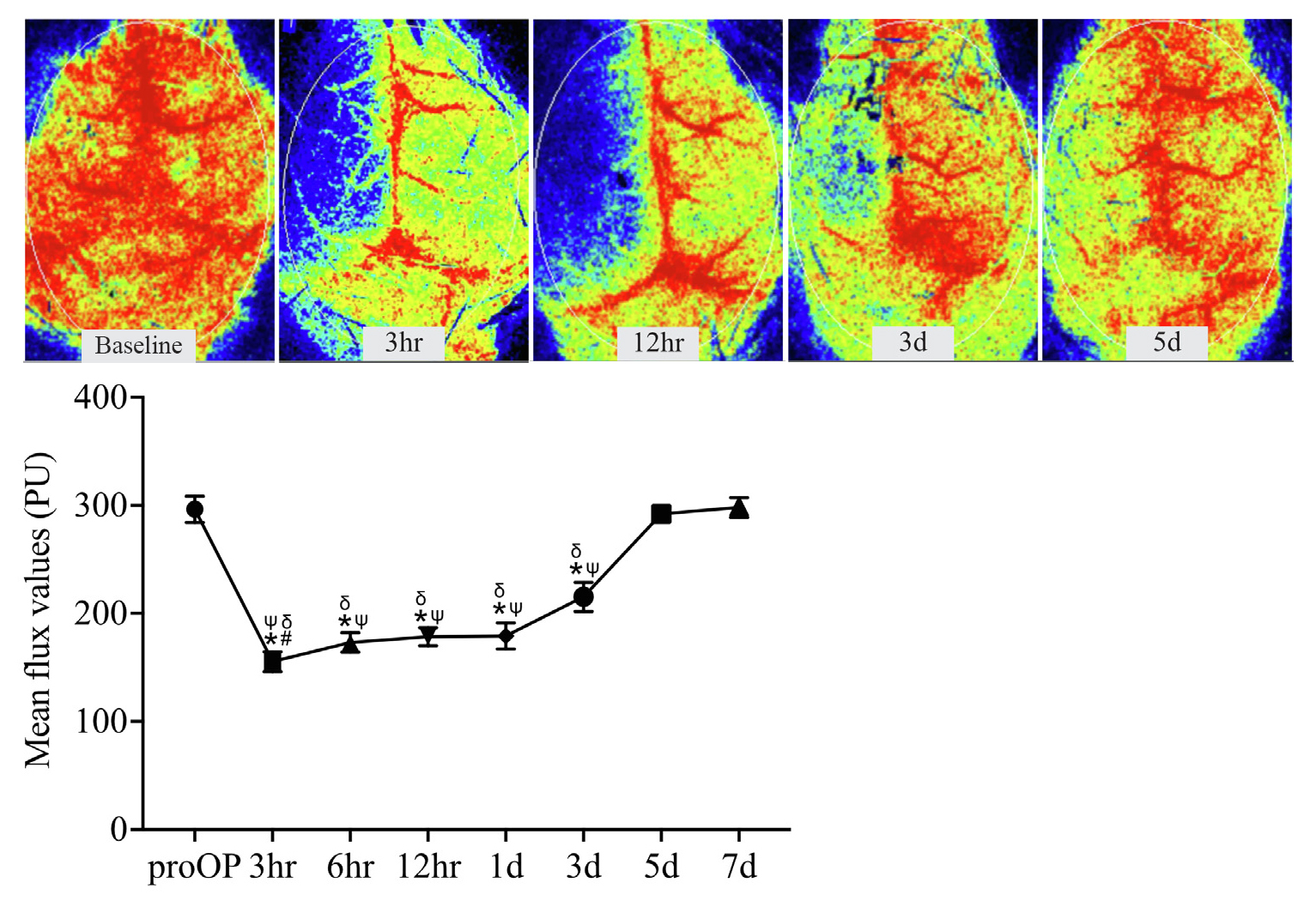
Brain Research, volume 1727 (2020) 146566
Images de la perfusion d’un cerveau de souris avant et après une une lésion par HSA. Le même animal a été suivi pendant une semaine après la lésion afin de suivre son rétablissement. Images acquises avec PSI HR.
Hypoperfusion cérébrale chronique
o Modèle d’occlusion bilatérale des artères carotides communes (OBACC) – Les artères carotides communes sont doublement ligaturées de manière ferme à l’aide de sutures ou de microbobines pour créer des régions ischémiques dans les deux hémisphères 14-20.
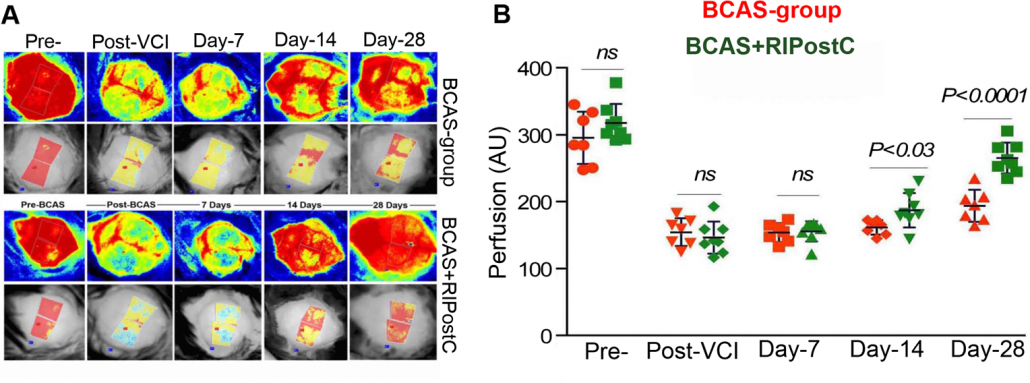
Images de la perfusion de cerveaux de souris avant et après OBACC, avec quantification des changements de perfusion sanguine chez les animaux traités et non traités. Les animaux ont été suivis pendant un mois après l’apparition des lésions.
Images fournies par le Dr Nasrul Hoda Georgia, Regents University, Université de Géorgie, et Charlie Norwood VA Medical Center, Augusta, GA.
Figure reproduite avec l’autorisation de Translational Stroke Research et initialement publiée dans : Khan, M.B., Hoda, M.N., Vaibhav, K. et al. Remote Ischemic Postconditioning: Harnessing Endogenous Protection in a Murine Model of Vascular Cognitive Impairment. Transl. Stroke Res. 6, 69–77 (2015). https://doi.org/10.1007/s12975-014-0374-6.
Lésions cérébrales traumatiques
o Modèle d’impact cortical contrôlé (ICC) – Un dispositif de contusion est utilisé pour provoquer une lésion au niveau du cortex sensorimoteur 21-23.
o Modèle de lâcher de poids/d’accélération d’impact – Un poids est lâché sur le crâne non protégé pour provoquer une lésion cérébrale.
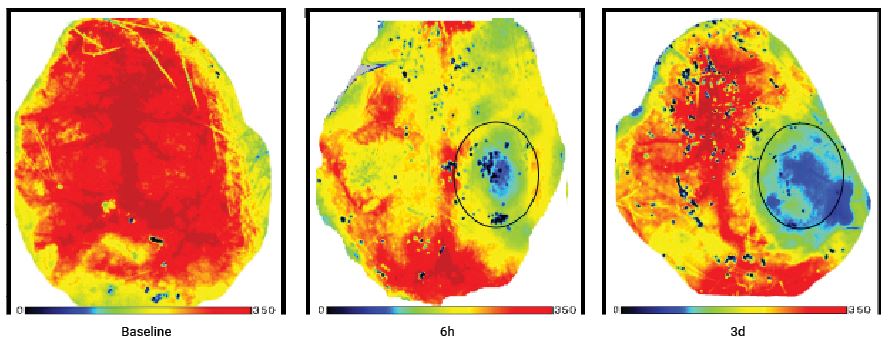
Images de la perfusion d’un cerveau de souris avant et après une lésion cérébrale traumatique. Le même animal a été suivi pendant 3 jours après la lésion.
Images fournies par le Dr Han Liu, Département de neurochirurgie, Premier hôpital affilié à l’Université de médecine de Chongqing, Chongqing 400016, RP de Chine
H. Liu et al./Brain Research 1700 (2018) 118–125
La PSI pour la caractérisation des modifications hémodynamiques du cerveau
Grâce à ses caractéristiques uniques et à sa capacité à visualiser les changements de la perfusion dans l’espace et dans le temps, la PSI permet d’étudier les petites modifications dynamiques du FSC en réponse à une stimulation. Les réponses anormales constituent des signes précoces de dysfonctionnement cognitif.
La fréquence d’images et la résolution spatiale élevées permettent de capturer les changements dynamiques de la microvascularisation cérébrale dans de petites structures résultant de stimuli externes.
L’imagerie différentielle permet de mieux visualiser les modifications plus subtiles du FSC.
Couplage neurovasculaire (CNV)
Mécanisme homéostatique essentiel qui garantit un ajustement adéquat du FSC en fonction des augmentations de la demande en en oxygène et en nutriments des neurones activés, produisant une hyperémie fonctionnelle. Le CNV joue un rôle majeur dans le maintien de l’intégrité de la fonction cognitive. La PSI permet d’enregistrer les modifications hémodynamiques survenant dans le cortex somatosensoriel en réaction à une stimulation électrique du nerf sciatique 24 ou des vibrisses 25-28. Un dysfonctionnement du CNV contribue au déclin cognitif lié à l’âge.
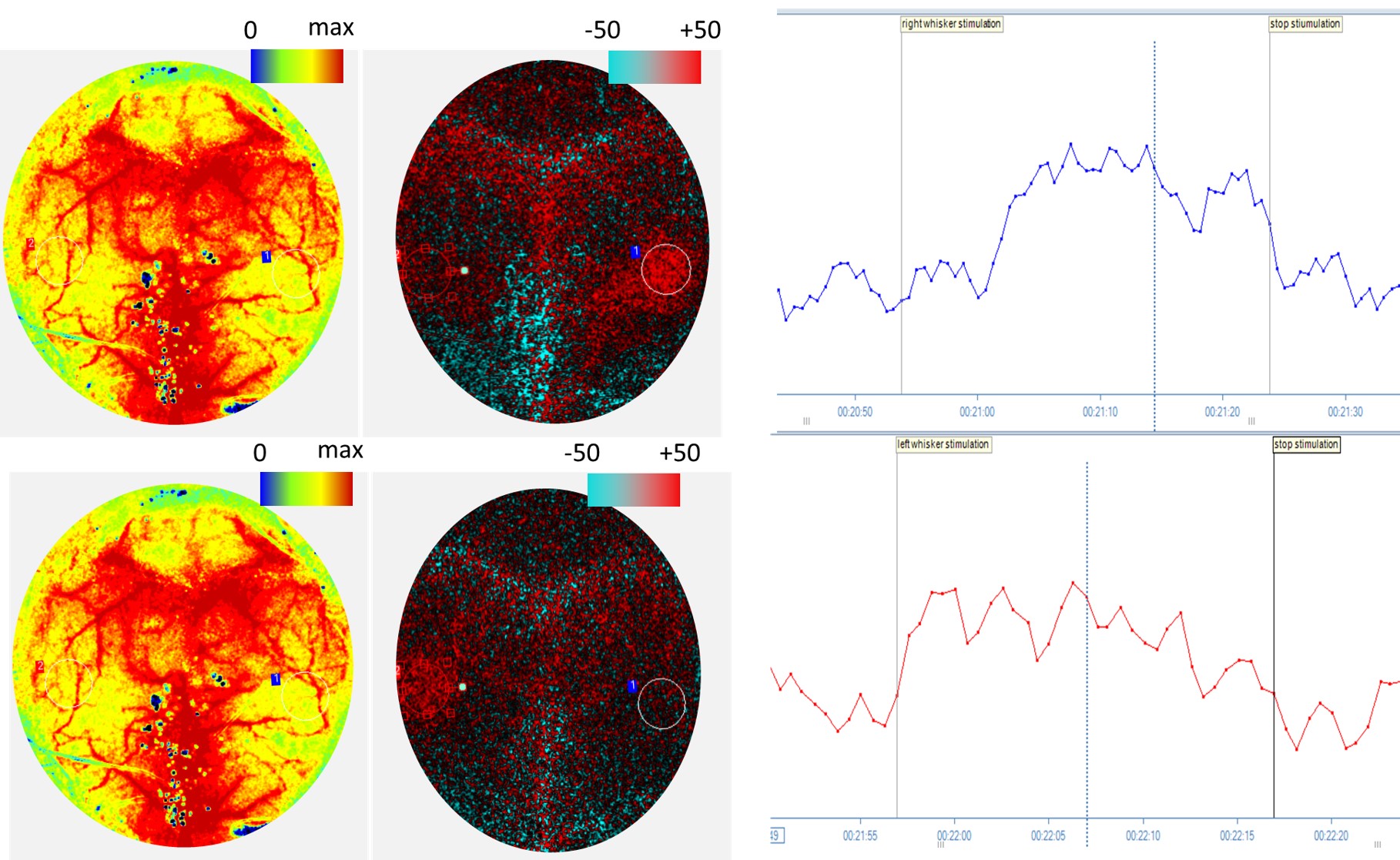
Images de la perfusion d’un cerveau de souris, représentées en images absolues et différentielles, durant la stimulation des vibrisses droites (haut) et gauches (bas) pendant 30 secondes. Données graphiques PIMSoft de ROI du cortex en tonneau pendant la stimulation, laquelle est censée entraîner une augmentation de la perfusion. Un dysfonctionnement cognitif se traduit par une réduction des augmentations de la perfusion en réaction à la stimulation.
Images fournies par le Dr Stefano Tarantini et le Dr Zoltan Ungvari de l’University of Oklahoma Health Science Center, Oklahoma City, OK.
Dépression corticale envahissante (DCE)
Vagues de perte soudaine et quasi-totale de gradients ioniques transmembranaires des neurones, responsables d’œdème cytotoxique et qui se propagent à une vitesse d’environ 3 mm/min dans la matière grise cérébrale, entraînant une ischémie diffuse. La DCE joue un rôle central dans la neurodégénérescence consécutive à une lésion cérébrale aiguë. La PSI permet d’enregistrer les changements hémodynamiques dus à une piqûre ou à une application locale d’une solution de potassium fortement concentrée 29-32.
Vagues de perte soudaine et quasi-totale de gradients ioniques transmembranaires des neurones, responsables d’œdème cytotoxique et qui se propagent à une vitesse d’environ 3 mm/min dans la matière grise cérébrale, entraînant une ischémie diffuse. La DCE joue un rôle central dans la neurodégénérescence consécutive à une lésion cérébrale aiguë. La PSI permet d’enregistrer les changements hémodynamiques dus à une piqûre ou à une application locale d’une solution de potassium fortement concentrée 29-32.
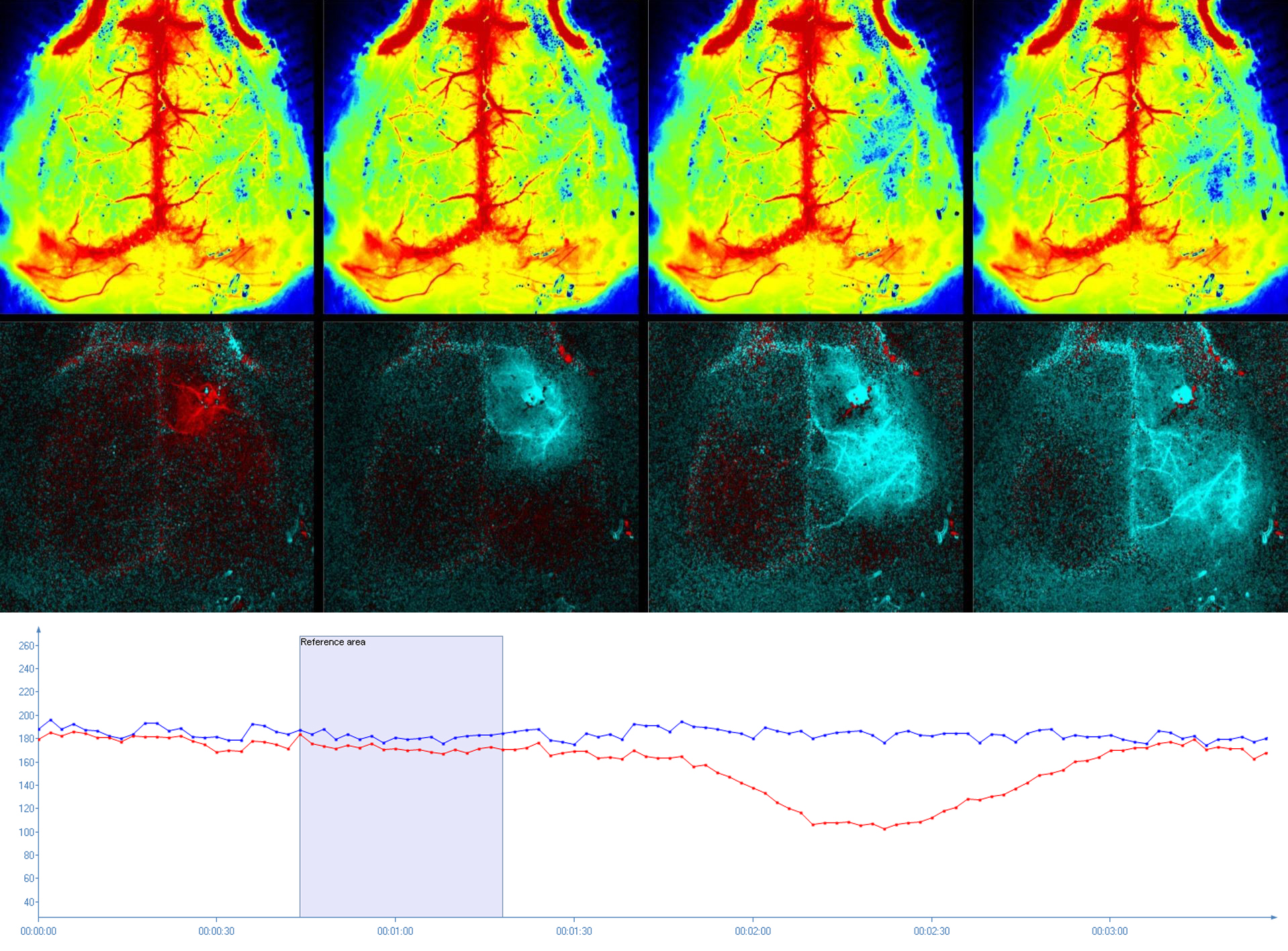
Imagerie de dépression envahissante dans le cerveau d’une souris par PeriCam PSI HR. La perfusion absolue (ligne supérieure) peut être visualisée et quantifiée (graphique) ; au moyen du mode d’imagerie différentielle (ligne inférieure), développé spécifiquement, la variation de la perfusion causée par la vague de DE peut être suivie de manière spectaculaire. Images fournies par Charité, Berlin, Allemagne.
References:
1. Morroniside promotes angiogenesis and further improves microvascular circulation after focal cerebral ischemia/reperfusion. T. Liu, B. Xiang, D. Guo, F. Sun, Re. Wei, G. Zhang, H. Aia, X.Tian, Z. Zhu, W. Zheng, Y. Wanga W.Wang. 2016, Brain Res Bull. , pp. 111-118.
2. C‐C Chemokine Receptor Type 5 (CCR5)‐Mediated Docking of Transferred Tregs Protects Against Early Blood‐Brain Barrier Disruption After Stroke. Peiying Li, Long Wang, Yuxi Zhou, Yu Gan, Wen Zhu, Yuguo Xia, Xiaoyan Jiang, Simon Watkins, Alberto Vazquez, Angus W. Thomson, Jun Chen, Weifeng Yu, Xiaoming Hu. 2017, Journal of the American Heart Association, p. e006387.
3. Endothelium-targeted overexpression of heat shock protein 27 ameliorates blood–brain barrier disruption after ischemic brain injury. Yejie Shi, Xiaoyan Jiang, Lili Zhang, Hongjian Pu, Xiaoming Hu, Wenting Zhang, Wei Cai, Yanqin Gao, Rehana K. Leak, Richard F. Keep, Michael V. L. Bennett, and Jun Chen. 2017, PNAS, Proceedings of the National Academy of Sciences, pp. E1243-E1252.
4. Brain ischemic preconditioning protects against ischemic injury and preserves the blood-brain barrier via oxidative signaling and Nrf2 activation. Tuo Yang, Yang Sun, Leilei Mao, Meijuan Zhang, Qianqian Li, Lili Zhang, Yejie Shi, Rehana K. Leak, Jun Chen, Feng Zhang. 2017, Redox Biology, pp. 323-337.
5. Brain-Derived Glia Maturation Factor β Participates in Lung Injury Induced by Acute Cerebral Ischemia by Increasing ROS in Endothelial Cells. Fei-Fei Xu, Zi-Bin Zhang, Yang-Yang Wang & Ting-Hua Wang. 2018, Neuroscience Bulletin, pp. 1077-1090.
6. The microRNA miR-7a-5p Ameliorates Ischemic Brain Damage by Repressing α-Synuclein. Kim T, Mehta SL, Morris-Blanco KC, Chokkalla AK, Chelluboina B, Lopez M, Sullivan R, Kim HT, Cook TD, Kim JY, Kim H, Kim C, Vemuganti R. 2018, Science Signaling, p. eaat4285.
7. Assessing the effects of Ang-(1-7) therapy following transient middle cerebral artery occlusion. M. M. C. Arroja, E. Reid, L. A. Roy, A. V. Vallatos, W. M. Holmes, S. A. Nicklin, L. M. Work & C. McCabe. 2019, Scientific Reports, p. 3154.
8. Modulation of brain cation-Cl− cotransport via the SPAK kinase inhibitor ZT-1a. Jinwei Zhang, Mohammad Iqbal H. Bhuiyan, Ting Zhang, Jason K. Karimy, Zhijuan Wu, Victoria M. Fiesler, Jingfang Zhang, Huachen Huang, Md Nabiul Hasan, Anna E. Skrzypiec, Mariusz Mucha, Daniel Duran, Wei Huang, Robert Pawlak, Lesley M. Foley, T. Kevin Hitc. 2020, Nature Communications.
9. Endothelium-targeted deletion of the miR-15a/16-1 cluster ameliorates blood-brain barrier dysfunction in ischemic stroke. Feifei Ma, Ping Sun, Xuejing Zhang, Milton H. Hamblin, and Ke-Jie Yin. 2020, Science Signaling.
10. Early Changes of Brain Perfusion After Subarachnoid Hemorrhage – the Effect of Sodium Nitroprusside. M Kolar, K Nohejlova, J Mares, J Pachl. 2016, Physiological Research, pp. S591-S599.
11. Changes of Cortical Perfusion in the Early Phase of Subarachnoid Bleeding in a Rat Model and the Role of Intracranial Hypertension. M Kolar, K Nohejlova, F Duska, J Mares, J Pachl. 2017, Physiological Research, pp. S545-S551.
12. Neuroprotective Effects of Nasopharyngeal Perfluorochemical Cooling in a Rat Model of Subarachnoid Hemorrhage. Mustafa Yavuz Samanci, Gennaro Calendo, Sandy T. Baker, Kadir Erkmen, Michael W. Weaver, Marla R. Wolfson. 2019, World Neurosurgery, pp. e481-e492.
13. Tauroursodeoxycholic acid prevents ER stress-induced apoptosis and improves cerebral and vascular function in mice subjected to subarachnoid hemorrhage. Xin Chen, Jianhao Wang, Xiangliang Gao, Ye Wu, Gang Gu, Mingming Shi, Yan Chai, Shuyuan Yue, Jianning Zhang. 2020, Brain Research, p. 146566.
14. TREM-2-p38 MAPK signaling regulates neuroinflammation during chronic cerebral hypoperfusion combined with diabetes mellitus. Jiawei Zhang, Yu Liu, Yaling Zheng, Yan Luo, Yu Du, Yao Zhao, Jian Guan, Xiaojie Zhang & Jianliang Fu. 2020, Journal of Neuroinflammation, Vol. 17.
15. Chronic Remote Ischemic Conditioning Is Cerebroprotective and Induces Vascular Remodeling in a VCID Model. Mohammad Badruzzaman Khan, Sherif Hafez, Md. Nasrul Hoda, Babak Baban, Jesse Wagner, Mohamed E. Awad, Hasith Sangabathula, Stephen Haigh, Mohammed Elsalanty, Jennifer L. Waller, David C. Hess. 1, 2018, Translational Stroke Research, Vol. 9, pp. 51-63.
16. Astroglial NF-kB contributes to white matter damage and cognitive impairment in a mouse model of vascular dementia. Raman Saggu, Toni Schumacher, Florian Gerich, Cordula Rakers, Khalid Tai, Andrea Delekate and Gabor C. Petzold. 4, 2016, Acta Neuropathologica Communications, Vol. 76.
17. Astrocyte-derived lipocalin-2 mediates hippocampal damage and cognitive deficits in experimental models of vascular dementia. Suk, Jae‐Hong Kim Pan‐Woo Ko Ho‐Won Lee Ji‐Young Jeong Maan‐Gee Lee Jong‐Heon Kim Won‐Ha Lee Ri Yu Won‐Jong Oh Kyoungho. 2017, Glia, pp. 1-20.
18. Cerebral microvascular dysfunction in metabolic syndrome is exacerbated by ischemia–reperfusion injury. Nathalie Obadia, Marcos Adriano Lessa, Anissa Daliry, Raquel Rangel Silvares, Fabiana Gomes, Eduardo Tibiriçá & Vanessa Estato. 67, 2017, BMC Neuroscience, Vol. 18.
19. The impact of early aerobic exercise on brain microvascular alterations induced by cerebral hypoperfusion. Marina Leardini-Tristão, Juliana Pereira Borges, Felipe Freitas, Raquel Rangel, Anissa Daliry,. 2017, Brain Research, Vol. 1657, pp. 43-51.
20. The Role of Autophagy in the Correlation Between Neuron Damage and Cognitive Impairment in Rat Chronic Cerebral Hypoperfusion. Wenying Zou, Yufei Song, Yumei Li, Yu Du, Xiaojie Zhang, Jianliang Fu. 1, 2018, Molecular Neurobiology, Vol. 55, pp. 776-791.
21. Clinical and Basic Evaluation of the Prognostic Value of Uric Acid in Traumatic Brain Injury. Liu H, He J, Zhong J, Zhang H, Zhang Z, Liu L, Huang Z, Wu Y, Jiang L, Guo Z, Xu R, Chai W, Huo G, Sun X, Cheng C. 10, 2018, International Journal of Medical Sciences, Vol. 15, pp. 1072-1082.
22. Selective activation of cannabinoid receptor-2 reduces neuroinflammation after traumatic brain injury via alternative macrophage polarization. Molly Braun, Zenab T.Khan, Mohammad B.Khan, Manish Kumar, Ayobami Ward, Bhagelu R.Achyut, Ali S.Arbab, David C.Hess, Md. Nasrul Hoda, Babak Baban, Krishnan M.Dhandapani, Kumar Vaibhav. 2018, Brain, Behavior, and Immunity, Vol. 68, pp. 224-237.
23. Evolution of cerebral perfusion in the peri-contusional cortex in mice revealed by in vivo laser speckle imaging after traumatic brain injury. Han Liu, Junchi He, Zhaosi Zhang, Liu Liu, Gang Huo, Xiaochuan Sun, Chongjie Cheng. 2018, Brain Research, Vol. 1700, pp. 118-125.
24. Regulation of cortical blood flow responses by the nucleus basalis of Meynert during nociceptive processing. Thierry Paquette, Ryota Tokunaga, Sara Touj, Hugues Leblond, Mathieu Piché. 149, 2019, Neuroscience Research, pp. 22-28.
25. Demonstration of impaired neurovascular coupling responses in TG2576 mouse model of Alzheimer’s disease using functional laser speckle contrast imaging. Stefano Tarantini, Gabor A. Fulop, Tamas Kiss, Eszter Farkas, Dániel Zölei-Szénási, Veronica Galvan, Peter Toth, Anna Csiszar, Zoltan Ungvari, Andriy Yabluchanskiy. 4, 2017, GeroScience, Vol. 39, pp. 465-473.
26. Overexpression of catalase targeted to mitochondria improves neurovascular coupling responses in aged mice. Anna Csiszar, Andriy Yabluchanskiy, Anna Ungvari, Zoltan Ungvari & Stefano Tarantini. 5, 2019, GeroScience, Vol. 41, pp. 609-617.
27. Pharmacological or genetic depletion of senescent astrocytes prevents whole brain irradiation–induced impairment of neurovascular coupling responses protecting cognitive function in mice. Andriy Yabluchanskiy, Stefano Tarantini, Priya Balasubramanian, Tamas Kiss, Tamas Csipo, Gábor A. Fülöp, Agnes Lipecz, Chetan Ahire, Jordan DelFavero, Adam Nyul-Toth, William E. Sonntag, Michal L. Schwartzman, Judith Campisi, Anna Csiszar & Zoltan Ungvari. 2020, GeroScience.
28. Treatment with the mitochondrial-targeted antioxidant peptide SS-31 rescues neurovascular coupling responses and cerebrovascular endothelial function and improves cognition in aged mice. Stefano Tarantini, Noa M. Valcarcel-Ares, Andriy Yabluchanskiy, Gabor A. Fulop, Peter Hertelendy, Tripti Gautam, Eszter Farkas, Aleksandra Perz, Peter S. Rabinovitch, William E. Sonntag, Anna Csiszar, Zoltan Ungvari. 2, 2018, Aging Cell, Vol. 17, p. e12731.
29. The antagonism of prostaglandin FP receptors inhibits the evolution of spreading depolarization in an experimental model of global forebrain ischemia. Dániel P. Varga, Írisz Szabó, Viktória É. Varga, Ákos Menhyárt, Orsolya M. Tóth, Mihály Kozma, Armand R. Bálint, István A. Krizbai, Ferenc Bari, Eszter Farkas. 2020, Neurobiology of Disease, Vol. 137, p. 104780.
30. Na+/K+-ATPase α isoform deficiency results in distinct spreading depolarization phenotypes. Clemens Reiffurth, Mesbah Alam, Mahdi Zahedi-Khorasani, Sebastian Major and Jens P Dreier. 3, 2019, Journal of Cerebral Blood Flow & Metabolism, Vol. 40, pp. 622-638.
31. Systemic administration of l-kynurenine sulfate induces cerebral hypoperfusion transients in adult C57Bl/6 mice. Dániel Péter Varga, Ákos Menyhárt, Tamás Puskás, Ferenc Bari, Eszter Farkas, Zsolt Kis, László Vécsei, József Toldi, Levente Gellért. 2017, Microvascular Research, Vol. 114, pp. 19-25.
32. Ansari MZ, Kang EJ, Manole MD, Dreier JP, Humeau-Heurtier A. Monitoring microvascular perfusion variations with laser speckle contrast imaging using a view-based temporal template method. s.l. : Microvascular Research, 2017. pp. 49-59. Vol. 111.
Pour plus d’informations, merci de remplir le formulaire.
Avertissement : il est possible que certains produits sur le site Web de Perimed ne possèdent pas d’autorisation de vente sur tous les marchés.


